原发性痛经系指非盆腔器质性病变引起的痛 经,以患者下腹部痉挛性疼痛为主要临床表现。本 病多发于青年女性,国内报道其发病率约为 43% ~ 69%。国外流行病学调查显示,原发性痛经的发病 率由 34%(埃及)至 94%(阿曼)不等,其中重度痛经 的患病率约为 0.9%~59.8%。随着生活压力增加、 饮食结构改变等因素的影响,原发性痛经的发病率 呈逐年上升趋势,对女性的生活与工作造成了严重影响。
1 材料与方法
1.1 实验仪器
NewClassic MF 电子分析天平(瑞士Mettler Toledo 公司);Xianou-24 高通量多样品组织 研磨机 (南京先欧仪器制造有限公司);Varioskan Lux 多 功 能 微 孔 板 读 数 仪 (美 国 Thermo Fisher Scientific 公 司);Wellwash 全 自 动 洗 板 机 (美 国 Thermo Fisher Scientific 公司);BGZ-240 电热鼓风干燥箱 (上海博迅实业有限公司医疗设备厂); ProFlex Base PCR 系统 (美国 Applied Biosystems 公 司);Milli -Q Integral 5 超 纯 水 系 统 (美 国 Merck Millipore 公司);Legend Micro 21R 冷冻高速离心机 (美国 Thermo Fisher Scientific 公司)。
1.2 实验药品与试剂
元胡止痛口服液的处方由 醋延胡索、白芷两味中药组成,辅料为蔗糖、β 环糊 精、甜菊素、纯化水,由河南福森药业有限公司提 供,批号:18090121,实验时用蒸馏水稀释成所需浓 度的溶液。罗通定片的有效成分为延胡索乙素(每 片 30 mg),购自山西云鹏制药有限公司,批号: G180302,实验时取出片剂研磨成细粉,加入蒸馏水 与 0.5%(W/V)羧甲基纤维素钠,配制成所需浓度的 混悬液。己烯雌酚(上海源叶生物科技有限公司,批 号:X13M6Y1);缩宫素(大连美仑生物技术有限公 司,批号:N1108A);羧甲基纤维素钠(上海申光食用 化学品有限公司,批号:20180816);肝素钠(北京索 莱宝科技有限公司,批号:409G024);水合氯醛(上 海源叶生物科技有限公司,批号:Z23A9Y68668)。 E2 酶联反应吸附实验(ELISA)检测试剂盒(批号: L181010239) 与 PGF2a ELISA 检测试剂盒 (批号: L181023119) 购自武汉云克隆科技股份有限公司。 大鼠 Prog ELISA 检测试剂盒 (批号:20181112005) 购自武汉六合生物技术有限公司。大鼠 PGE2 ELISA 检测试剂盒(批号:C0174080121)、大鼠 TXB2 ELISA 检测试剂盒 (批号:A27017483) 与大鼠 6-ketoPGF1α ELISA 检测试剂盒(批号:D10017485)购自武 汉华美生物工程有限公司。MDA 检测试剂盒(批号: 082418181030)、总 SOD 活性检测试剂盒 (批号: 092618181030)、GSH -Px 检 测 试 剂 盒 ( 批 号 : 060518181114)、NO 检 测 试 剂 盒 ( 批 号 : 052218181029)与 BCA 蛋白浓度测定试剂盒(批号: 070618181017) 购自上海碧云天生物技术研究所。 Ca2+ 试剂盒(批号:20181123)购自南京建成生物工 程研究所。
1.3 实验动物
SD 大鼠,雌性,体质量 180~200 g, SPF 级,购自北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2017-0001。饲养于中国医学科学院放射医学研究所实验动物中心,饲养设施合 格证号:SVXK 津 2009-0002。实验动物操作均遵从 中国医学科学院放射医学研究所实验动物伦理委 员会审定的规范要求。
1.4 分组与造模方法
将 60 只健康雌性 SD 大鼠 按体质量随机分为 6 组,分别为空白组、模型组、元 胡止痛口服液高剂量组(高剂量组)、元胡止痛口服 液中剂量组(中剂量组)、元胡止痛口服液低剂量组 (低剂量组)以及罗通定片阳性药组(阳性药组),每 组 10 只。参考文献方法复制痛经大鼠模型。除空 白组外,其余各组大鼠灌胃给予己烯雌酚 2.00 mg/kg, 每日 1 次,连续 12 d。
1.5 给药方法
于造模第 6 天开始给药,根据预实 验结果,高剂量组、中剂量组、低剂量组大鼠分别以 3.20、1.07、0.36 g/kg 剂量灌胃给予元胡止痛口服液。 根据实验动物与人之间药物剂量等效换算方法,阳 性药组大鼠灌胃给予罗通定混悬液 0.03 g/kg。空白 对照组与模型组灌胃等体积蒸馏水,各组大鼠每日 给药 1 次,连续给药 7 d。
1.6 扭体反应观察
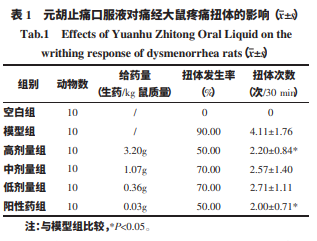
于造模第 12 天,末次给药 1 h 后,模型组、高剂量组、中剂量组、低剂量组与阳性 药组大鼠腹腔注射缩宫素 40 U/kg,空白组注射等体 积生理盐水。记录注射缩宫素后 30 min 内各组大鼠 发生扭体反应(腹部收缩内凹,躯干与后肢伸展,臀 部与一侧肢体内旋)的数量以及扭体次数,并按公 式 1 计算大鼠的扭体发生率。 扭体发生率(%)=发生扭体反应动物数量/实验 动物数量×100%(公式 1)
1.7 检测指标
注射缩宫素 1 h 后,各组大鼠腹腔 注射 3.50%(V/V)水合氯醛溶液(0.10 mL/kg)麻醉, 腹主动脉采血,加入肝素抗凝管,于 1 500 g,4 ℃条 件下离心 5 min,取上清液,采用 ELISA 法测定大鼠 血浆 E2 与 Prog 水平,采用 TBA 法检测大鼠血浆 MDA 含量,运用 WST-8 法测定血浆 SOD 活性,并 采用紫外比色检测 GSH-Px 活性。 另于采血后取大鼠子宫组织,精密称质量,加 入生理盐水,在冰浴下制成 10%(W/V)的组织匀浆, 于 1 500 g、4 ℃条件下离心 10 min,分离上清液,采 用ELISA 法测定大鼠子宫组织匀浆中 PGF2α、PGE2、 TXB2、6-keto-PGF1α 水平。采用甲基百里香酚蓝比色 法测定组织匀浆中 Ca2+ 含量,运用 Griess 试剂法测 定 NO 含量,并采用 BCA 法测定大鼠组织匀浆总蛋 白含量。上述测定方法均按各试剂盒说明进行,实验数据采用 ELISACalc 软件进行分析,以四参数 Logistic 曲线模型拟合标准曲线,并通过标准曲线计 算各样本浓度。
1.8 统计学方法
采用 SPSS 19.0 软件进行统计分 析,实验结果以均数±标准差(x±s)表示,正态分布资 料采用单因素方差分析比较多组间差异,偏态分布 资料采用 Wilcoxon 秩和检验分析,P<0.05 表示差异 有统计学意义。
2 结果
空白组大鼠未出现扭体反应, 模型组大鼠在注射缩宫素后 30 min 内的扭体发生 率为 90%,提示动物模型成功建立。与模型组相比, 阳性药组、高剂量组、中剂量组、低剂量组大鼠扭体 发生率均有不同程度的降低,其中高剂量组与阳性 药组大鼠扭体反应次数显著减少,差异具有统计学 意义(P<0.05),详见表 1。

与正常大鼠相比,原发性 痛经模型大鼠血浆 E2 水平显著升高(P<0.01),血浆 Prog 水平显著降低(P<0.05)。但阳性药与元胡止痛 口服液给药后,模型大鼠血浆 E2 与 Prog 水平均未 见显著回调。见图 1。
3 讨论
原发性痛经的主要症状表现为周期发作的下 腹部痉挛性疼痛,缩宫素诱导的痛经动物模型是观察原发性痛经疼痛程度的首选模型,而扭体反应则 是评价动物疼痛程度的经典行为学指标,目前在原 发性痛经的机制与防治研究中有广泛应用。本研 究首先灌胃给予大鼠己烯雌酚以提高子宫敏感性, 之后注射缩宫素诱发子宫痉挛性收缩,观察到模型 大鼠出现典型的扭体反应,与文献报道一致,提示 痛经大鼠模型的成功建立。进一步研究发现,元胡 止痛口服液可显著减少痛经大鼠扭体反应发生次 数,降低大鼠扭体反应发生率,提示元胡止痛口服 液对缩宫素诱导的痛经大鼠模型具有显著的镇痛作用。